Xơ gan là một bệnh gan mạn tính được đặc trưng bởi sự thay thế mô gan bằng mô xơ, sẹo và sự thành lập các nốt tân sinh, dẫn đến mất chức năng gan. Những tiến bộ gần đây trong sự hiểu biết của chúng ta về các con đường liên quan đến sự tiến triển từ gan bị tổn thương đến xơ gan đã dẫn đến nhiều liệu pháp mới đang được nghiên cứu như là phương pháp chữa trị tiềm năng và chất ức chế hình thành xơ gan.
1. Vai trò của cà phê
Đã có vô số nghiên cứu điều tra việc tiêu thụ cà phê và tác dụng bảo vệ của nó đối với xơ hóa gan và xơ gan do nhiều căn nguyên. Trong một nghiên cứu được thực hiện bởi Modi và cộng sự, tiêu thụ caffein trên phân vị thứ 75 trong nhóm thuần tập nghiên cứu có liên quan đến giảm xơ hóa gan (OR: 0,19; KTC 95%: 0,05 – 0,66; P = 0,009). Một nghiên cứu dựa trên dân số tiềm năng gần đây đã đánh giá độ cứng của gan trong dân số nói chung không mắc bệnh gan. Nghiên cứu kết luận rằng, tỷ lệ người tham gia đo độ cứng gan 8,0 kPa giảm khi tiêu thụ cà phê nhiều hơn.

Đã có vô số nghiên cứu điều tra việc tiêu thụ cà phê và tác dụng bảo vệ của nó đối với xơ hóa gan và xơ gan do nhiều căn nguyên.
2. Vai trò của các chất ức chế hệ thống renin-angiotensin
Các chất ức chế hệ thống renin-angiotensin đã cho thấy nhiều hứa hẹn trong việc giảm sự tiến triển của xơ hóa gan trong các mô hình thử nghiệm. Trong một nghiên cứu được thực hiện bởi Moreno và cộng sự, phân phối mục tiêu losartan đến HSC ở chuột bị xơ hóa gan thứ phát sau thắt ống mật. Việc sử dụng carbon tetrachloride đã chứng minh giảm sự lắng đọng collagen, nguyên bào sợi, viêm và biểu hiện gen procollagen; giảm xơ hóa gan.
Kết quả tương tự cũng được chứng minh trên một mô hình chuột thioacetamide gây xơ gan. Những con chuột được sử dụng thuốc đối kháng thụ thể angiotensin II losartan hoặc telmisartan cho thấy nồng độ yếu tố hoại tử khối u-alpha giảm, yếu tố tăng trưởng biến đổi beta-1, giảm viêm và xơ gan về mặt mô học. Một tổng quan hệ thống gần đây và phân tích tổng hợp đánh giá tác dụng của thuốc ức chế men chuyển và thuốc chẹn thụ thể angiotensin trên bệnh nhân xơ gan hoặc xơ gan đã chứng minh việc giảm các dấu hiệu xơ hóa huyết thanh bao gồm TGF-β, chất ức chế mô của metalloproteinase-1 (TIMP-1), MMP, collagen và hiển thị điểm số xơ hóa thấp hơn đáng kể và diện tích xơ hóa nhỏ hơn.
Một nghiên cứu ngẫu nhiên có đối chứng nhãn mở đã chứng minh tác dụng của candesartan ở bệnh nhân xơ gan do rượu còn bù (≥ F2). Candesartan làm giảm đáng kể điểm xơ hóa dẫn đến cải thiện mô học, giảm diện tích xơ hóa và actin cơ trơn, và giảm biểu hiện TGF-β, TIMP-1 và MMP ( P<0,05). Mặc dù hiệu quả đã được chứng minh trong cả nghiên cứu trên động vật và con người, các thử nghiệm lâm sàng thành công hơn nữa là cần thiết để triển khai một cách an toàn và tự tin việc sử dụng các loại thuốc này ở người.
3. Vai trò của yếu tố tăng trưởng tế bào gan
Yếu tố tăng trưởng tế bào gan là một tác nhân khác đã được nghiên cứu trên động vật. Nó phát huy tác dụng điều trị bằng cách ức chế hoạt động của TGF-β, gây ra biểu hiện collagenase và ức chế sự phát triển của HSC, ngăn chặn quá trình chết tế bào. Tuy vậy, cần có thêm các nghiên cứu sâu hơn trên người để hiểu rõ hơn về bất kỳ lợi ích tiềm năng nào trong quá trình xơ hóa gan.
4. Vai trò của thuốc ức chế Caspase
Thuốc ức chế Caspase là một nhóm thuốc điều trị tiềm năng bổ sung. Quá trình apoptosis của tế bào gan là một quá trình viêm dẫn đến hoạt hóa và xơ hóa tế bào. Các nghiên cứu trên động vật đã phát hiện ra rằng, việc sử dụng chất ức chế pan caspase IDN-6556 (Emricasan) làm giảm quá trình apoptosis của tế bào gan và tổn thương gan, viêm gan và tạo sợi gan trên mô hình chuột.
Một thử nghiệm lâm sàng ngẫu nhiên, có đối chứng với giả dược gần đây (ENCORE-NF; NCT02686762) đã đánh giá tác dụng của emricasan ở bệnh nhân xơ NASH F1-F3. Điều trị bằng Emricasan không cải thiện mô học ở những bệnh nhân này và thậm chí còn làm trầm trọng thêm tình trạng xơ hóa.
Thử nghiệm pha 2 (ENCORE-PH; NCT02960204) đánh giá ảnh hưởng của emricasan trên gradient áp lực tĩnh mạch gan (HVPG) ở bệnh nhân xơ gan và tăng áp lực tĩnh mạch cửa nặng, được định nghĩa khi HVPG ≥ 12 mmHg. Kết quả cho thấy không có sự khác biệt đáng kể về sự thay đổi của HVPG giữa các liều emricasan khác nhau so với giả dược.
Mặc dù ban đầu emricasan đã chứng minh giảm các dấu ấn sinh học như aminotransferase, caspase và cytokeratins; các dấu ấn sinh học này trở lại mức ban đầu vào cuối giai đoạn điều trị 48 tuần. Nó cũng đã được báo cáo trên các phương tiện truyền thông rằng, phân tích chính của thử nghiệm giai đoạn 2 (ENCORE-LF NCT03205345) cho thấy emricasan không đáp ứng được tiêu chí chính của nghiên cứu là sống sót không có biến cố khi so sánh với giả dược.
5. Vai trò của hệ thống nội tiết trong gan
Hệ thống nội tiết trong gan là một trong nhiều con đường truyền tín hiệu tế bào liên quan đến quá trình chuyển đổi HSC đang tĩnh lặng thành nguyên bào sợi tạo ra ma trận sợi. Quá trình này kích hoạt thụ thể CB1 thúc đẩy quá trình nhiễm mỡ ở gan, viêm nhiễm và xơ hóa sau đó; thường thấy ở cả bệnh gan nhiễm mỡ do rượu và không do rượu.
Thụ thể CB2 chủ yếu có tác dụng chống viêm và chống xơ hóa, thể hiện vai trò bảo vệ chống lại tổn thương gan. Trong các nghiên cứu khác nhau trên động vật, việc ức chế thụ thể CB1 bằng rimonabant làm giảm mức TGF-β và xơ hóa, cũng như hoạt động của MMP và các yếu tố tiền sinh và tiền viêm.
Tuy nhiên, một điều rút ra đối với phương pháp điều trị này là có rất nhiều tác dụng trị liệu thần kinh vì các thụ thể CB2 được biểu hiện nhiều trong hệ thần kinh trung ương. Chủ nghĩa CB2 đã được chứng minh là làm giảm viêm và xơ hóa và thậm chí đẩy nhanh quá trình tái tạo ở các mô hình chuột và chuột khác nhau. Mặc dù dược phẩm nhắm vào cả hai thụ thể có thể có triển vọng trong các nghiên cứu trên động vật, nhưng chất chủ vận CB2 có thể là một phương pháp điều trị khả thi hơn.
Thụ thể CB1 và CB2 có tác động trái ngược nhau.
6. Các liệu pháp khác nhằm mục đích thúc đẩy sự suy thoái của quá trình sợi hoá gan
Trong nghiên cứu năm 2004 được thực hiện bởi Parsons và cộng sự, sự ngăn chặn TIMP-1 thông qua kháng thể chống TIMP-1 dẫn đến giảm sự lắng đọng collagen ở mô hình chuột. Bất chấp những phát hiện này, hiện không có thử nghiệm lâm sàng nào đang cố gắng nhắm vào con đường này. Một cách tiếp cận khác để cản trở ECM là bằng cách đối kháng với lysyl oxidase-2, một trong những enzym chịu trách nhiệm liên kết chéo của collagen sợi.
Một thử nghiệm mới hoàn thành gần đây (NCT01672853) đã đánh giá hiệu quả của Simtuzumab (anti lysyl oxidase-2 Ab) trên PSC. Sau 96 tuần điều trị, không có thay đổi đáng kể về hàm lượng collagen trong gan, giảm giai đoạn xơ hóa Ishak hoặc tiến triển thành xơ gan. Các thử nghiệm lâm sàng tương tự điều tra simtuzumab ở bệnh nhân xơ gan tiến triển thứ phát sau NASH đã bị chấm dứt sau khi không cho thấy hiệu quả (NCT01672879 và NCT01672866).
7. Vai trò của yếu tố Endothelin
Endothelin kích thích sự co bóp của HSC, và các chất đối kháng với các thụ thể của nó ban đầu cho thấy hứa hẹn trong điều trị xơ gan. Trong một mô hình thử nghiệm về xơ hóa gan, các nhà khoa học đã chứng minh rằng với việc sử dụng bosentan (một chất đối kháng thụ thể endothelin), mức độ collagen loại I và mRNA fibronectin của tế bào đã giảm xuống. Tuy nhiên, bằng chứng về độc tính trên gan và khả năng gây quái thai đã phát triển. Việc sử dụng nó không còn được khuyến cáo nữa.
Như đã thảo luận trước đó, cytokine TGF-β đóng một vai trò quan trọng trong sự phát triển của xơ hóa trong gan và các mô khác. Do đó, nó vẫn là trọng tâm chính cho các phương pháp điều trị dược phẩm khác nhau. Đã có lo ngại về sự ức chế toàn thân gây ra viêm và tăng trưởng biểu mô và tân sinh tiếp theo. Điều này đã dẫn đến các nghiên cứu sâu hơn về các phương pháp điều trị khác.
Các chất đối kháng với tích phân bề mặt tế bào, cho phép kích hoạt TGF-β đã trở thành một mục tiêu hấp dẫn. Một ví dụ là kháng thể ức chế αVβ6 integration, đã cho thấy làm giảm đáng kể sự lắng đọng collagen ở mô hình thắt ống mật của chuột. Sự ức chế α (V) Tích phân cũng đã được chứng minh là làm giảm quá trình ở mô hình động vật.
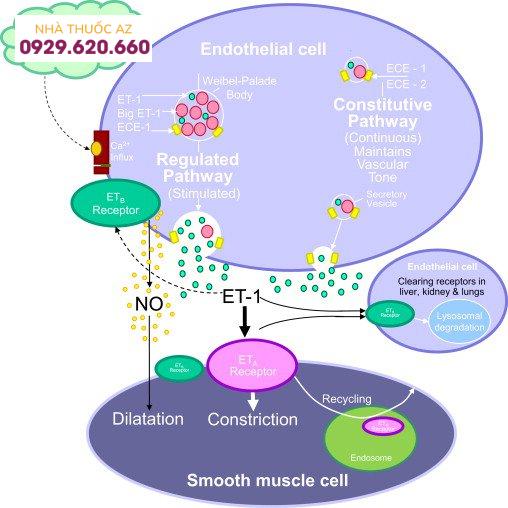
Endothelin kích thích sự co bóp của HSC, và các chất đối kháng với các thụ thể của nó ban đầu cho thấy hứa hẹn trong điều trị xơ gan.
8. Các nghiên cứu lâm sàng hiện tại
Một loạt các thử nghiệm lâm sàng đang diễn ra và đã hoàn thành nhắm vào các con đường khác nhau của xơ hóa gan. Ví dụ về các loại thuốc đang được nghiên cứu hiện nay bao gồm Pirfenidone, một loại thuốc chống xơ hóa phổ rộng thể hiện khả năng ngăn ngừa và loại bỏ các mô sẹo collagenous trong các cơ quan như phổi và thận.
Pegbelfermin (BMS-986036) và Aldafermin (NGM282), các chất tương tự của yếu tố tăng trưởng nguyên bào sợi lần lượt là 21 và 19, đang được nghiên cứu khi điều trị trong NASH. Vì chúng chứng minh nhiều tác dụng sinh hóa và trao đổi chất tiềm năng có lợi. Việc hoàn thành các thử nghiệm lâm sàng này có thể mang lại kết quả hiệu quả và việc sử dụng chúng trong bệnh xơ hóa gan. Bởi những loại thuốc này hiện không được sử dụng phổ biến trong môi trường lâm sàng.
9. Kết luận
Sự hình thành xơ hóa gan và tiến triển thành xơ gan là một cơ chế phức tạp có tác động qua lại giữa sự hình thành chất nền xơ và sự suy thoái của nó. Có rất nhiều nguyên nhân dẫn đến xơ hóa và xơ gan, tỷ lệ mắc bệnh khác nhau tùy theo vị trí địa lý trên toàn thế giới. Mặc dù có những biến thể trong bệnh lý cơ bản, nhiều con đường sinh học phổ biến cuối cùng dẫn đến kích hoạt HSC được chia sẻ giữa các bệnh.
Trong những năm qua, có rất nhiều tác nhân dược lý và không dùng thuốc, cũng như việc thay đổi lối sống, đã cho thấy một số hứa hẹn trong việc ngăn ngừa sự tiến triển và thậm chí đảo ngược xơ gan, biến việc điều trị thành hiện thực.
Các nhà khoa học sẽ không chỉ tiếp tục nghiên cứu hiệu quả của từng loại thuốc mà nên tiếp tục phát triển các liệu pháp kết hợp nhắm vào các điểm khác nhau của chuỗi xơ hóa đồng thời. Lợi ích tiềm năng cũng có thể được khám phá bằng cách sử dụng các hợp chất có liên quan đến các dạng xơ hóa hệ thống khác, vì nhiều con đường được chia sẻ giữa các hệ thống cơ quan.
Việc xác định hiệu quả của thuốc vẫn còn là một thách thức vì có nhiều phương thức khác nhau có sẵn để đánh giá tình trạng xơ hóa gan, khác xa với sinh thiết gan truyền thống.
Như đã thấy, có vô số các thử nghiệm lâm sàng từ các nghiên cứu quan sát và điều trị. Theo ý kiến của các tác giả, các nghiên cứu trong tương lai bắt buộc phải chuẩn hóa các tiêu chí lâm sàng và đo độ xơ hóa để cho phép hiểu rõ hơn về hiệu quả của thuốc dưới dạng thuốc đơn lẻ hoặc kết hợp với nhau. Trong khi hầu hết các thử nghiệm hiện đang tập trung vào MAFLD, tiếp tục nghiên cứu là việc làm cần thiết để cải thiện tình trạng xơ gan trên toàn thế giới.
Để biết thêm các thông tin chi tiết, vui lòng liên hệ với Nhà thuốc AZ theo số hotline 0929 620 660 hoặc truy cập vào website: https://nhathuocaz.com.vn